INTRODUCCIÓN
En esta Práctica se cálculo del punto de fusión y de ebullición de diferentes sustancias. Como su propio nombre indica, había que encontrar mediante los procesos indicados por el profesor, el punto de fusión y el de ebullición e ir anotando los datos obtenidos por el termómetro en el tiempo indicado. OBJETIVO
• Determinar la temperatura de fusión de algunos sólidos puros.• Determinar la temperatura de ebullición de algunos liquidos puros.
MARCO TEÓRICO
Punto de Fusión es la temperatura a la cual la materia pasa de estado sólido a estado líquido, es decir, se funde.
es relativamente insensible a la presión y, por tanto, pueden ser utilizados para caracterizar compuestos orgánicos y para comprobar la pureza.
Punto de ebullición Es la temperatura a la cual se produce la transición de la fase líquida a la gaseosa. En el caso de sustancias puras a una presión fija, el proceso de ebullición o de vaporización ocurre a una sola temperatura; conforme se añade calor la temperatura permanece constante hasta que todo el líquido ha hervido.
MATERIALES
Mechero solido problema
capilares liquido problema
tubos de ensayo aceite
termómetro tubos de laboratorio
beackers
capilares liquido problema
tubos de ensayo aceite
termómetro tubos de laboratorio
beackers
PROCEDIMIENTO
Punto de Ebullición
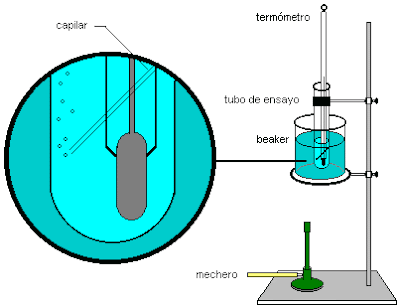
A un tubo de ensayo pequeño añadimos el líquido problema, se introduce un capilar sellado por uno de sus extremos de modo que el extremo abierto toque el fondo del tubo y luego se adiciona el termómetro. El sistema se coloca en un baño de aceite, tal como se ilustra en la figura.
T inicial = 30 grados.
T ebullicion= 82 grados.
T ebullicion= 82 grados.
Punto de Fusión
Se introduce una pequeña cantidad del sólido pulverizado en un capilar previamente sellado por un extremo, compactándolo bien hasta el fondo del extremo sellado. El capilar se sujeta al termómetro con hilo, asegurándose que la muestra quede a la misma altura del bulbo del termómetro . Se sumergen ambos en un baño de aceite sin que éste entre en el capilar.
T inicial = 30 grados.
T. Fusion= 92 grados.
CONCLUSIÓN
Concluimos que al calentar sustancias hay cambios en las composiciones quimicas de las mismas. lo que nos deja ver que el traspaso de energia genera transformaciones que son reversbles en algunos casos .
BIBLIOGRAFIA
Fotocopias entregadas por el docente.